| 25 años generando CONFIANZA
ISO 14971
La norma ISO 14971 para la Gestión de Riesgos en Dispositivos Médicos especifica un proceso que debe seguir el fabricante para identificar los peligros vinculados con los dispositivos médicos, incluyendo los dispositivos para Diagnostico In Vitro (IVD), para estimar y evaluar los riesgos asociados, para controlar estos riesgos y para monitorear la eficacia de los controles
¿Cuál es el alcance de la norma ISO 14971?
- Los requisitos son aplicables a todas las etapas del ciclo de vida del dispositivo médico
- No aplica a la toma de decisiones clínicas
- No especifica los niveles de riesgo aceptables
- Esta norma internacional no requiere que el fabricante tenga un Sistema de Gestión de Calidad implementado. Aunque, esta Gestión de Riesgos puede formar parte del Sistema de Gestión de Calidad.
Definiciones a tener en cuenta por la ISO 14971
Daño: Lesión física o deterioro de la salud de las personas, o daño a la propiedad o al ambiente.
Peligro: Potencial fuente de daño.
Situación Riesgosa: Circunstancia en la cual las personas, la propiedad o el medio ambiente están expuestos a uno o más peligros.
Severidad: Medida de las posibles consecuencias de un peligro.
Riesgo: Combinación de la probabilidad de ocurrencia de daño y el grado de severidad de tal daño.
Riesgo residual: Riesgo que permanece después de haber tomado las medidas de control de riesgos.
Uso previsto: Finalidad Prevista Uso del producto, proceso o servicio, que se pretende de acuerdo a las especificaciones, instrucciones y la información provista por el fabricante.
Dispositivo Médico: Cualquier instrumento, aparato, implemento, máquina, dispositivo, implante, reactivos o calibrador in vitro, software, material o cualquier otro ítem, similar o de uso relacionado que el fabricante pretende para ser utilizado solo o en combinación para seres humanos para uno o más de los siguientes propósitos:
- Diagnóstico, prevención, monitoreo o tratamiento, o alivio de enfermedades.
- Diagnóstico, monitoreo, tratamiento, alivio o compensación de una lesión.
- Investigación, reemplazo. Modificación o soporte de la anatomía o de un proceso fisiológico.
- Soporte o sostenimiento de la vida.
- Control de la concepción.
- Desinfección de dispositivos médicos.
- Proveer información para propósitos médicos por medio de examinaciones in vitro de muestras obtenidas del cuerpo humano.
- Y que no realiza su función principal en o sobre el cuerpo humano por medios farmacológicos, inmunológicos o metabólicos, pero que puede ser apoyado en su función por tales medios.
Proceso de gestión de riesgos
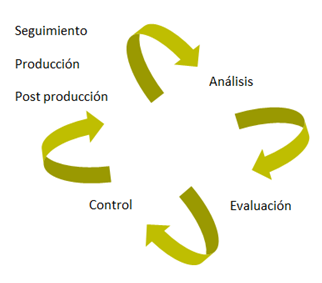
La Gestión de Riesgo es la aplicación sistemática de políticas, procedimientos y prácticas de gestión a las tareas de analizar, estimar, controlar y monitorear riesgos.
Responsabilidades de la Alta Dirección
- Asegurar la provisión de recursos adecuados.
- Asegurar la asignación de personal calificado.
- Definir y documentar su política para determinar criterios para la aceptabilidad de riesgos, teniendo en cuenta Normas Internacionales, regulaciones nacionales o internacionales, información disponible.
- Revisar la adecuación del proceso de gestión de riesgos a intervalos planificados para asegurar la continua eficacia del proceso de gestión de riesgos y documentar cualquier decisión y acción tomada
Calificación del personal
- Conocimiento y experiencia apropiado a las tareas asignadas
- Conocimiento y experiencia del:
– Dispositivo médico o similar
– Del uso previsto
– Tecnologías involucradas
– Técnicas de gestión de riesgos
- Registros
Archivo de gestión de riesgos
Se trata del conjunto de registros y otros documentos que se producen por un proceso de gestión de riesgos.
- Debe ser establecido y mantenido por el fabricante
- Debe proveer trazabilidad para cada peligro identificado a :
– Análisis de riesgo
– Evaluación de riesgo
– Implementación y verificación de las medidas de control
– La evaluación de cualquier riesgo residual
Análisis de riesgo a través de la documentación
- Descripción e identificación del dispositivo
- Uso previsto
- Características cuantitativas y cualitativas que pueda afectar a la seguridad
- Lista de peligros conocidos o previsibles
- Estimación de riesgos
- Persona y organización
- Alcance y fecha
- Cumplimiento es verificado por inspección del archivo de gestión de riesgo
Diseño inherente a seguridad
- Eliminar el riesgo en particular
- Reducir la probabilidad de ocurrencia del daño
- Reducir la severidad
Medidas protectoras
- Uso de corte automático o válvulas de seguridad
- Uso de alarmas acústicas o visuales para alertar al operador de las condición riesgosa
Valoración del riesgo residual
- Control para determinar si las medidas llevan al riesgo a un valor aceptable
- Los mismos criterios definidos en el plan de gestión de riesgos
- Riesgos residuales no aceptables, aplicar medidas adicionales hasta reducir hasta valores aceptables.
- Riesgos aceptables, decidir sobre qué riesgo debe ser revelado y que información es necesaria incluir en los documentos acompañantes
Análisis riesgo y beneficios
- Riesgo inaceptable y medidas de control de riesgos no practicas
- Justificar aceptabilidad del riesgo basado en el beneficio
- Recopilar y revisar datos y literatura para determinar si los beneficios compensan el riesgo residual
- Individuos experimentados y con conocimiento específico
- Ensayos clínicos
Software para ISO 14971
La norma ISO 14971 puede ser automatizada fácilmente con el Software ISOTools. Esta herramienta facilita en todo momento la implementación y mantenimiento de los Sistemas de Gestión de Calidad para la Gestión de Riesgos en Dispositivos Médicos.
- IWA 48 vs. ISO 53001: principales diferencias
- Implementar un sistema de gestión de IA: componentes clave, retos y pasos a seguir
- Administración de la calidad: 5 tendencias clave que marcarán 2025
- IWA 48:2024 – Implementación de principios ambientales, sociales y de gobernanza (ESG)
- Soberanía de datos: concepto, retos y buenas prácticas
¿Desea saber más?
Entradas relacionadas
Implementar un sistema de gestión de IA es la vía para impulsar la innovación con base en Inteligencia…
2025 es el año en que el área de administración de la calidad asume el liderazgo en las…







